Molecular Catalysis:腈水合酶的激活蛋白的研究进展

腈水合酶(NHase, EC 4.2.1.84)是一种非常有价值的生物催化剂,能够在温和的条件下将腈类化合物转化为相应的酰胺类化合物。
很多研究团队通过计算和实验研究解析了腈水合酶的催化机制,截至目前,仍存在较大的争议。现阶段被大家广泛接受的催化机制主要有以下四种:
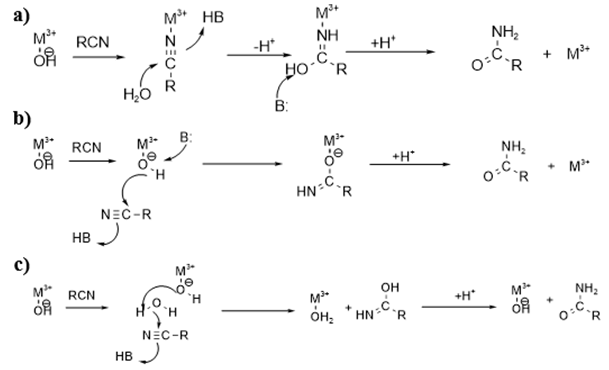
图1. 腈水合酶的催化机制
其中三种催化机制a-c均建立在推测之上,并没有直接的、强有力的依据。而催化机制d则是通过解析腈水合酶复合物的晶体结构发现的,在PtNHase中,被氧化为半胱氨酸-次磺酸的第113位氨基酸残基作为亲核试剂可以直接攻击与金属离子配位的底物,并形成共价结合的酰亚胺中间体,一旦发生质子转移,过渡态产物酰亚胺上的碳原子(pathway B)或αCys113(pathway A)在受到水分子的亲核攻击时,酰亚胺最终异构化为酰胺。
利用腈水合酶作为生物催化剂生产的酰胺类产品在工业、农业及医药等领域有着极大的应用价值。目前,腈水合酶可用于生产丙烯酰胺和烟酰胺等小体积酰胺化合物,这类化合物已作为大宗化学品广泛使用。未来,腈水合酶还可用于合成大体积酰胺类化合物,这类化合物通常是高价值药品的原料及医药中间体,具体图2所示:
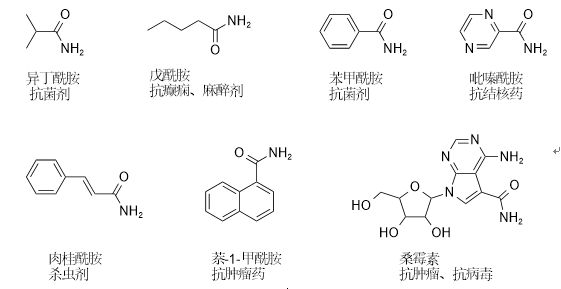
图2. 高价值酰胺类化合物及应用
腈水合酶基因簇上的激活蛋白能够促进NHase的成熟,从而影响NHase的催化能力。本篇综述概述了激活蛋白在机制、能量利用、灵活性和表达等方面的最新研究进展。
一、激活蛋白促进NHase成熟的机制
来自不同微生物的NHase基因簇排列方式不同,不同的基因排列方式会呈现出NHase成熟的不同机制,文中展现了多种编码NHase基因的基因簇,如图3所示,其中编码NHase的典型基因簇为图3A和图3B。NHase的成熟需要NHase形成结合金属的活性中心,NHase基因簇表达出的激活蛋白主要负责捕获金属离子并运输到活性中心,通过亚基之间的调整,从而激活NHase。
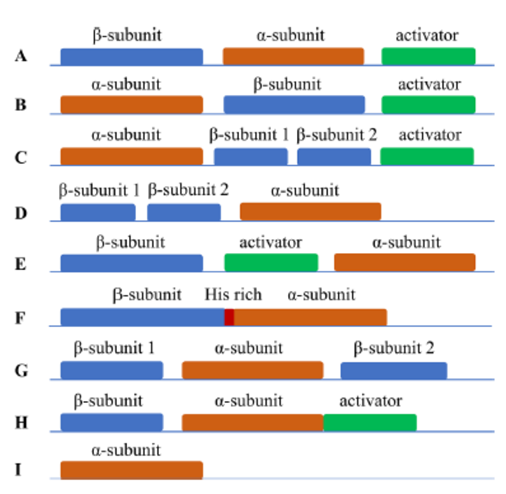
图3. 不同NHase基因簇的组成
本篇综述将激活蛋白促进NHase成熟的机制分为两种,一种是借助激活蛋白的自然成熟机制,另一种是通过亚基融合的成熟机制。
在NHase自然成熟机制中,根据活性中心结合的金属离子差异,NHase又可分为Co-NHases和Fe-NHases。本综述论述了如图4A-F所示的5种自然成熟机制,图中蓝色的球代表了Fe离子,紫色的球代表了Co离子,激活蛋白用‘γ’表示。详细的自然成熟机制如表1所示,表中提及的“亚基自身交换”指的是通过α-亚基上去质子化的Cys-SO2-、Cys-SO-和β-亚基上的两个精氨酸(R52和R157)之间的盐桥作用实现亚基自身交换。
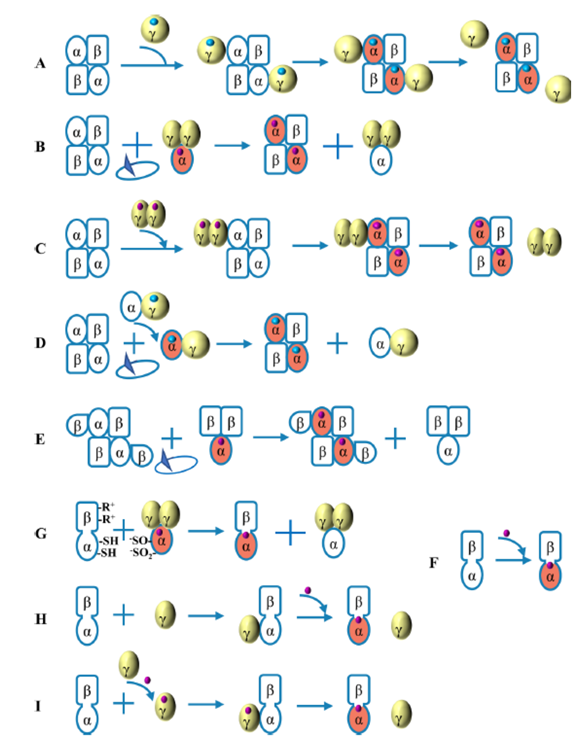
图4. NHase的成熟机制
表1. NHase的自然成熟机制


表2. NHase亚基融合的成熟机制

二、激活蛋白在金属离子转运过程中充当NTPase的角色
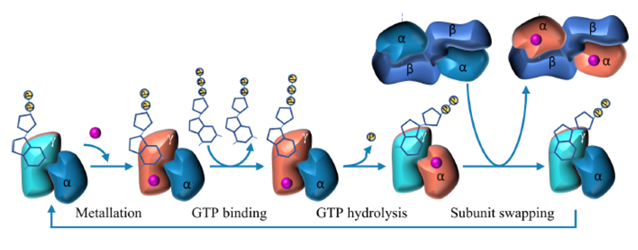
图5. 在Fe-NHase成熟过程中G3E P-loop GTPase的假设作用
在某些条件下金属离子的引入不需要额外的能量,NHase能够自发激活金属所在的活性中心的特定状态时,不需要NTP;体内NTP以分子伴侣蛋白的作用促使NHase重新折叠成活性状态时,NHase也不需要体外提供能量的NTP。
三、NHase激活蛋白的灵活性
NHase激活蛋白的灵活性分为作用机制灵活性和位点灵活性。激活蛋白的作用机制灵活性又分为① NHase基因簇内不同的基因排列意味着NHase的不同的自然成熟机制或亚基融合后的成熟机制;② NHase在体内和体外会采用不同的成熟机制,将来源于R. rhodochrous J1的脱辅基NHase、脱辅助因子的激活蛋白和钴离子在体外混合后,得到低活性的NHase,在相同的情况下,NHase在体内却具有活性;③ 激活蛋白在NHase成熟中扮演了分子伴侣蛋白、金属伴侣、NTPase等多种角色,如图6所示。
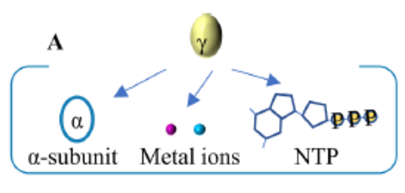
图6. 激活蛋白在NHase成熟中扮演的角色
根据激活蛋白具有的位点灵活性和结构依赖性,可以判断NHase激活蛋白是通过具有一定特征的结构促进半胱氨酸氧化,从而激活NHase。
四、NHase激活蛋白的表达
作者信息:周哲敏:https://biotech.jiangnan.edu.cn/szdw1/jzyg/zg1/zzm.htm
研究方向:发酵工程、酶催化转化。
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S2468823124004905?via%3Dihub.


