Claudin 18.2 ADC迎来破局
2024年2月,信达生物在Clinicaltrials.gov网站注册了IBI343治疗Claudin18.2阳性、HER2阴性胃癌的三期临床试验,这也是全球首款进入三期临床阶段的Claudin18.2 ADC新药。
Claudin 18.2 ADC催化将至,在胃癌尤其是胰腺癌的突破上值得期待。
Claudin 18.2
胃癌和胰腺癌的高选择性靶点
Claudin是人体正常组织中紧密连接最重要的一种蛋白质,具有4个跨膜结构域,参与集体生理过程如细胞旁通透性和电导的调节,共同构成了细胞旁屏障。该家族拥有至少24个成员,不同的Claudin蛋白表达于不同的组织,与各自组织肿瘤发生具有相关性,其中Claudin-1与结直肠癌高度相关,Claudin-10与肝细胞癌发生密切。
Claudin 18包含Claudin 18.1和Claudin 18.2两种异构体,其中Claudin 18.2与胃癌和胰腺癌关系密切。Claudin18.2是一种高度选择性的细胞谱系标记物,其在正常组织中的表达严格限于胃黏膜分化的上皮细胞。Claudin 18.2可在正常组织的恶性转化中保留,从而使其在极大比例的原发性转移性胃癌细胞中表达。Claudin18.2在70%至80%胃癌患者及约60%胰腺癌患者的癌组织中普遍表达,这种在正常细胞无/低表达、在癌细胞高表达的特性使Claudin 18.2近年来成为实体瘤免疫疗法的理想靶点,受到研究人员的高度关注。
Claudin 18.2 ADC
从国内到海外,多款药物实现授权
目前,全球共有超过十款在研Claudin18.2 ADC药物,绝大多数由国内创新药企业研发,临床进展居前的包括信达生物、康诺亚、礼新医药、恒瑞医药、荣昌生物等,其中信达生物的IBI343和康诺亚的CMG901已进入Ⅲ期临床。国外制药企业倾向于通过合作的方式获得Claudin 18.2 ADC,如阿斯利康引进康诺亚的CMG901,Turning Point Therapeutics与礼新医药合作开发LM-302。
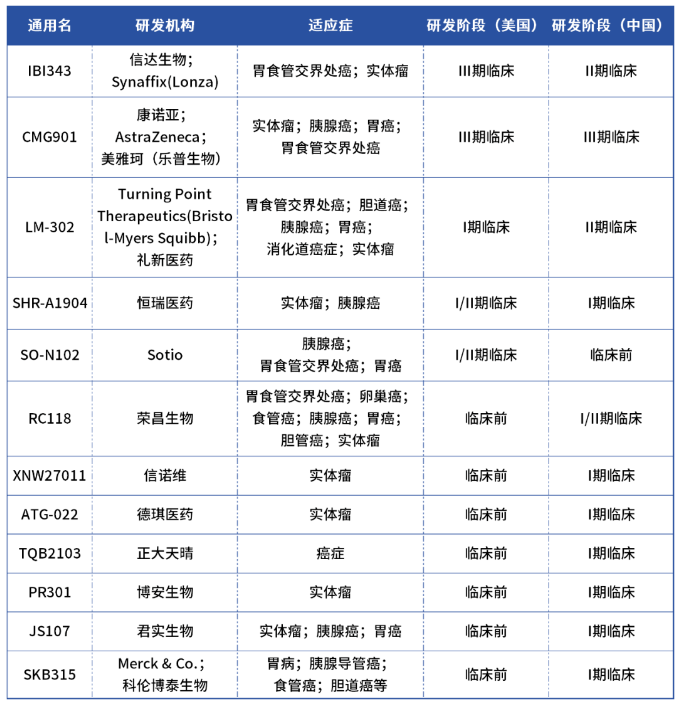
(1)IBI343是信达生物研发的重组人源抗CLDN18.2 ADC,与表达CLDN18.2的肿瘤细胞结合后,可发生CLDN18.2依赖性ADC内化,并释放毒素药物引起DNA损伤,导致肿瘤细胞凋亡。游离的毒素药物也可以通过质膜扩散到达并杀死相邻的肿瘤细胞,因此IBI343也具有旁观者效应。
2023年12月,信达生物与Synaffix(Lonza)宣布扩大ADC技术许可协议。信达生物将通过Synaffix的ADC核心技术平台,开发至少一款具有同类最佳潜力的ADC项目。信达生物将负责ADC项目的研究、开发、制造和商业化。Synaffix将获得合作首付款,并有资格获得潜在里程碑付款和基于商业净销售额的特许权使用费。
2024年2月,信达生物在Clinicaltrials.gov网站注册了IBI343治疗Claudin18.2阳性、HER2阴性胃癌的三期临床试验(NCT06238843),成为全球首款进入三期临床阶段的Claudin18.2 ADC新药。该研究计划入组450名受试者,对照组为伊利替康或紫杉醇,主要终点为PFS和OS,预计到2027年6月结束。
(2)CMG901是由康诺亚与乐普生物共同研发的一款Claudin 18.2靶向抗体偶联药物,用于治疗对标准治疗无反应或进展的实体瘤,特别是用于治疗胃癌及胰腺癌。CMG901由一个以Claudin 18.2为靶点的人源化单克隆抗体(CM311)、一个可裂解连接符和一种有效的细胞毒性载荷组成。
2023年2月23日,康诺亚非全资附属公司 KYM Biosciences(康诺亚拥有70%权益)与AstraZeneca订立全球独家许可协议,以开发及商业化CMG901。AstraZeneca将获得 CMG901的研究、开发、注册、生产及商业化的独家全球许可,并根据许可协议负责与其进一步开发及商业化相关的所有成本及活动。KYM Biosciences将收取6300万美元的预付款,并在达成若干开发、监管及商业里程碑后,收取最多11.25亿美元的额外潜在付款。
2023年11月,CMG901 的I期临床研究数据发表于ASCO Plenary Series。113例先前接受过二线治疗的胃癌╱胃食管结合部腺癌患者客观缓解率(ORR)达33%,确认的疾病控制率(DCR)为70%。2.2mg/kg 剂量组确认的ORR为42%,中位无进展生存期(mPFS)为4.8个月。与目前二线胃癌标准疗法雷莫芦单抗相比,CMG901在末线胃癌患者中mPFS更佳,在患者身体状况远不如前线的情况下读出了更好的数据,具有BIC的潜力。
除了胃癌外,阿斯利康已切入胰腺癌这一市场。2024年1月,AZ在clinicaltrials.gov更新临床II期 (NCT06219941)方案,探索CMG901/AZD0901单药在Cldn18.2+胃癌/GEJ(先前接受最多2L治疗),以及联用化疗在1L胰腺癌中的安全性、耐受性、有效性、PK和免疫原性的临床II期,预计2025年3月初步完成,主要终点为安全性和ORR。
(3)LM-302是礼新医药旗下一款靶向Claudin18.2 ADC,由Claudin18.2特异性抗体、可裂解连接子以及毒素载荷甲基澳瑞他汀E(MMAE)组成,目前处于Ⅱ期临床。2023年10月, LM-302拟被NMPA/CDE纳入突破性治疗品种,适应症为既往接受过二线及以上系统治疗的Claudin18.2阳性的局部晚期或转移性胃或胃食管交界处腺癌。
2022年5月,礼新医药授权Turning Point Therapeutics(被百时美施贵宝公司收购)在LM-302在全球除大中华区与韩国以外国家及地区的独家开发和商业化权益。根据协议,Turning Point将支付礼新医药2500万美元的首付款,研发里程碑付款1.95亿美元及后续商业化里程碑,总金额超过10亿美元。
(4)SHR-A1904为恒瑞自主研发且具有知识产权的靶向Claudin 18.2的抗体药物偶联物(ADC),该产品当前正在中国、美国、澳大利亚进行临床I期试验。
2023年10月30日,恒瑞医药与德国默克公司就PARP1 抑制剂HRS-1167达成独家许可协议。该协议还包括恒瑞自主研发的Claudin-18.2抗体药物偶联物(ADC)SHR-A1904的独家选择权。根据协议条款,恒瑞将获得1.6亿欧元的首付款、高至9000万欧元的技术转移费和行权费,以及研发里程碑付款、销售里程碑付款。以上潜在的付款总额可能高达14亿欧元。除此之外,默克还将向恒瑞支付高至两位数百分比的销售提成。
(5)RC118是荣昌生物自主研发的创新型抗体偶联药物(ADC),用于治疗Claudin 18.2表达阳性的局部晚期不可切除或转移性恶性实体瘤患者。2021年9月,RC118获得国家药品监督管理局药品审评中心(CDE)的I期临床试验批件。2022年12月,RC118获得美国食品药品监督管理局(FDA)颁发的两项孤儿药资格认定,分别针对胃癌(包括胃食管交界癌)和胰腺癌适应症。
小结
Claudin 18.2 ADC的研发趋于白热化。康诺亚的CMG901率先启动全球多中心三期临床,信达生物的IBI343是首款进入三期临床阶段的Claudin 18.2 ADC。除了胃癌外,Claudin 18.2在胰腺癌的表达高,且胰腺癌相较胃癌治疗需求更为迫切,潜在的获益和突破性远超胃癌,阿斯利康/康诺亚的CMG901/AZD0901已在美国启动胰腺癌的Ⅱ期临床,期待未来的破局。




