致病基因“猎手”——RNAi药物从发现到临床应用

导读:影响疗效的因素和未来发展方向

自1998年RNA干扰(RNAi)现象的发现以来,25年里这一技术已从发现走向了临床应用,为遗传性疾病治疗提供了新的可能性。
突破:RNAi药物从发现到临床应用
1998年,RNA干扰(RNA interference,RNAi)现象首次被发现。这是一种转录后水平的基因表达调控技术,能够使与之同源的靶基因mRNA特异性降解或翻译受阻,从而达到基因沉默的效果。RNAi技术的发现为基因表达调控提供了新的机制,特别是在治疗遗传性疾病方面,被授予了2006年诺贝尔生理学或医学奖。
小干扰RNA(small interference RNA, siRNA)药物正是基于RNAi技术的一种新型治疗方法,具有特异性沉默几乎任何治疗靶点的潜力,拥有前所未有的效力和持久性。
2018年,FDA批准了首款siRNA药物——Onpattro(Patisiran),由Alnylam公司开发用于治疗hATTR患者,代表了一种治疗疾病的全新方法。该药基于脂质纳米颗粒(LNPs)递送,这也是目前市场上唯一利用这一技术平台的siRNA药物。
此后,肝脏递送的主要平台由更有效的GalNAc偶联技术取代。目前,全球已有6个siRNA药物获批上市。
表1. 全球已上市的6个siRNA药物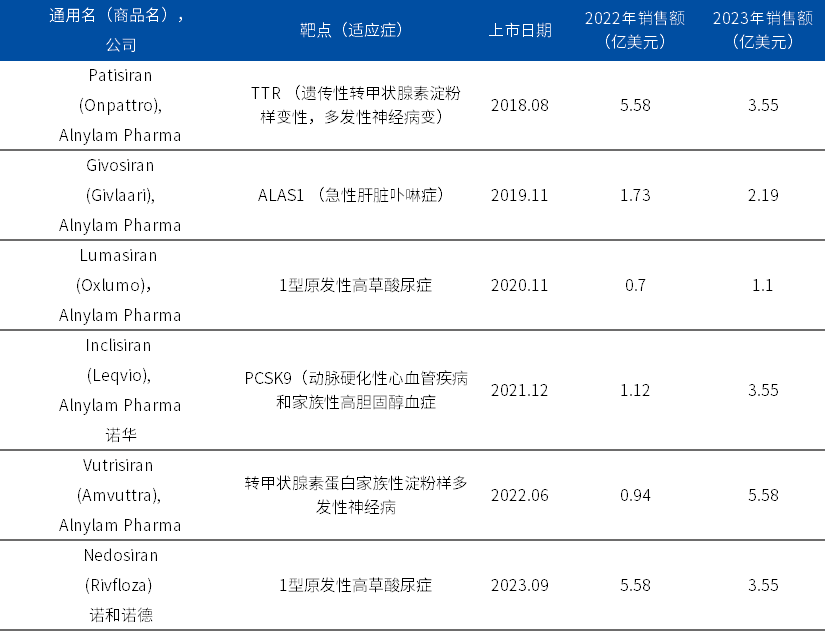
资料来源:FDA官网、博药整理
图1:Patisiran (Onpattro)结构式(2018年)
然而,siRNA药物仍面临诸多挑战,尤其是递送问题。目前已获批上市的siRNA药物全部都靶向肝内组织,治疗肝外疾病的效用仍然有限,还需要持续的创新。
挑战与创新:影响siRNA药物疗效的因素
尽管siRNA药物展现出巨大潜力,但其在体内的稳定性和生物利用度仍是主要挑战。化学修饰、计算机辅助设计和生物筛选、优化递送策略等方面的创新,为siRNA药物研发带来了新的希望和突破点。
化学修饰
由于siRNA药物是基于RNA结构进行设计的,而人体内又存在很多水解RNA的酶,因此在人的循环系统中,siRNA药物非常容易被水解掉,其表现为稳定性不足;另外一方面,siRNA药物是带有负电荷的核酸大分子,原则上很难通过细胞膜进入细胞内部发生作用;并且,siRNA还可以触发先天免疫反应并引起脱靶效应。
对 siRNA 进行化学修饰,可以提高其在血液中的化学稳定性、增加半衰期、降低免疫效应和脱靶效应。还可以在药物上连接一些配体,当配体与特定组织上的受体结合时,会引起特定细胞的内吞作用,使得 RNAi 药物具有靶向运输能力。
磷酸修饰:裸siRNA的核苷酸之间通过3',5'-磷酸二酯键连接,带有负电荷,容易被血液中的磷酸酶降解。最常见的修饰是将易被水解的磷酸二酯(phosphodiester,PO)替换为硫代磷酸酯(phosphorothioate,PS),可以显著地稳定 RNA 对核酸酶的降解,但过多的 PS 修饰可能导致毒性增加。除此之外,还可以将硼酸磷酸酯(BP)取代 ,效力更高,但目前缺乏大规模合成的优化方法。
核糖修饰:最常见的核糖修饰位点为核苷酸的 2'位,包括 2'-O-Me 和 2'-F,可以提高核酸酶抗性和结合亲和力,延长半衰期,使 siRNA 稳定性增强。此外,还可以引入锁核酸(LNA)修饰,即核糖的 2'-O 与 4'-C 之间形成共价键。将 LNA 插入 siRNA 序列可以增加生物稳定性和靶标结合亲和力。
碱基修饰:siRNA与mRNA 通过碱基互补形成氢键发挥作用,因此对碱基进行修饰会对 siRNA 的性能产生影响。常见的碱基修饰方法是用 5'-溴尿嘧啶、假尿嘧啶、2'-硫尿嘧啶、5'-碘尿嘧啶取代碱基,可以促进核苷酸之间氢键的形成,一定程度上提高稳定性。
综合考虑不同方面的化学结构调整,可以优化siRNA的靶向性和安全性,为其在治疗应用中的应用提供更广阔的前景。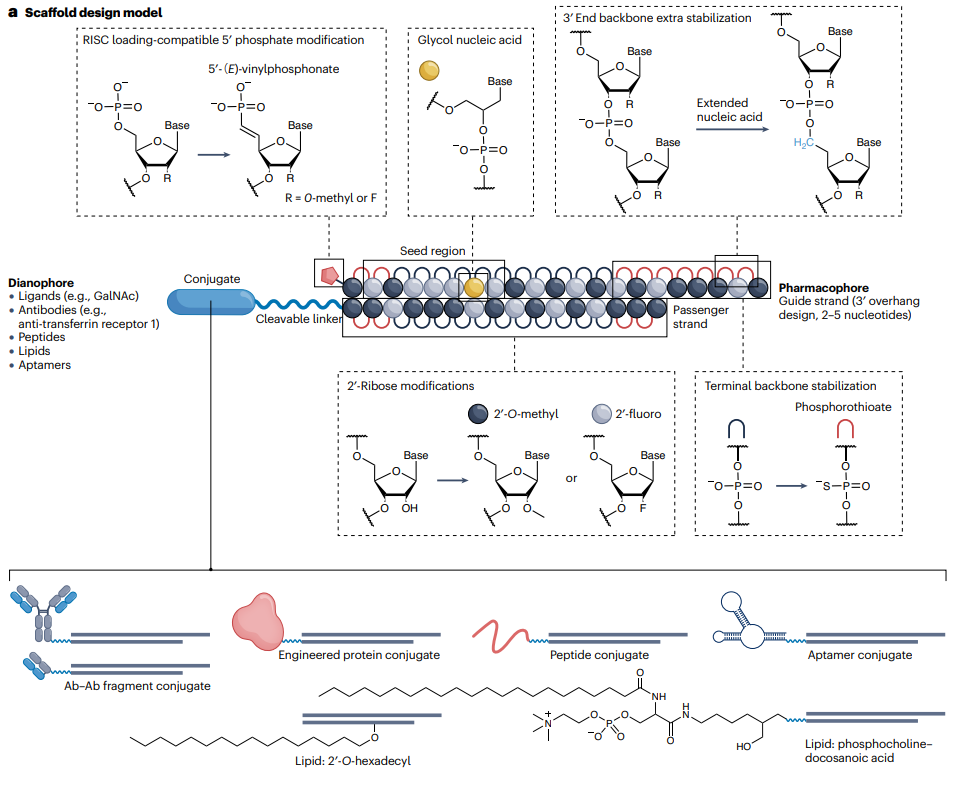
图1. siRNA结构修饰策略
图片来源:参考资料1
计算机辅助设计和生物筛选
siRNA的设计和生物筛选对疗效和安全性至关重要。通过计算机辅助设计,研究人员可以利用算法预测siRNA序列的功效和特异性。这些算法综合考虑了目标mRNA的可及性、热力学稳定性和非靶效应等因素。随后,潜在的siRNA候选序列还需要通过生物筛选来验证其活性和选择性。
siRNA的修饰策略对其体内功能性具有显著影响。但目前大多数公开可用的siRNA预测算法是基于未修饰的siRNA数据集,这限制了它们对修饰siRNA的预测能力。
在体外识别siRNA的活性较为简单,但体外效力并不总是能够直接转化为体内活性。因此,需要综合考虑体外和体内效力,并持续创新以提高预测准确性。
靶点特异性是设计siRNA时需要考虑的另一个关键因素。由于脱靶而产生的毒性在体内与体外仍然存在差异,这也是需要考虑的因素。
跨物种的siRNA设计可以简化临床前开发过程,但需要对人类和其他物种的靶序列同源性进行分析。在跨物种活性差异方面,仍然缺乏深入的生物学机制解释,需要更多的研究和创新。
递送策略
递送siRNA至目标细胞是RNAi疗法中不可忽视的一关。
为了克服siRNA递送的挑战,科学家们开发了各种递送方法,主要可分为病毒载体和非病毒载体;前者通常使用逆转录病毒、腺病毒等作为递送载体,具有较高的递送效率,但免疫反应风险和毒性等问题,限制了其临床应用。
相比之下,非病毒载体以其低毒性而具有更大的开发潜力,比如基于脂质体的纳米递送系统 和偶联介导的递送系统。
目前,LNP(脂质纳米颗粒)平台与GalNAc共轭连接递送系统平台已有产品获批上市。另外,Dicerna公司(已被诺和诺德收购)肝脏靶向的GalXC™递送平台可实现RNAi疗法的皮下给药,基于该平台开发的Nedosiran (Rivfloza)已于2023年获批上市,用于原发性高草酸尿症(PH)。
在肝外递送方面,Alnylam公司开发了十六烷基C16偶联技术,以鞘内给药方式尝试向中枢神经系统和眼部的递送,以及IKARIA™平台,对肺部、肌肉和脂肪组织的siRNA递送方法进行了改进。Codiak公司开发了外泌体递送平台。
此外,近年来无载体递送系统成为一种具有潜力的递送策略,将纳米药物递送与自组装技术相结合,在不借助载体材料的情况下,siRNA 之间自组装或与其他药物共组装,形成均匀稳定的纳米粒,这些纳米粒具有自递送能力,即同时作为递送载体和被递送的对象,包括脂质 siRNA 偶联物、抗体-siRNA 偶联物、多肽 siRNA 偶联物、核酸适配体-siRNA 结合物以及siRNA 与其他药物的共组装。
随着新材料、新技术和新策略的不断发展,siRNA的递送将会更加高效和安全,以实现siRNA药物的广泛应用。
未来:siRNA药物前景辽阔
siRNA药物具有明显的优势,包括“不可成药”的靶点、相对较短的开发周期以及长期稳定的临床疗效,这些优势使其已成为药物研发领域的一大亮点。展望未来,siRNA药物的应用范围预计将实现大幅扩展。
目前,多项使用脂质和抗体-蛋白质共轭物递送siRNA的临床项目已展现出显著的疾病治疗效果,这一进步可能预示着下一轮siRNA药物批准的浪潮即将到来。
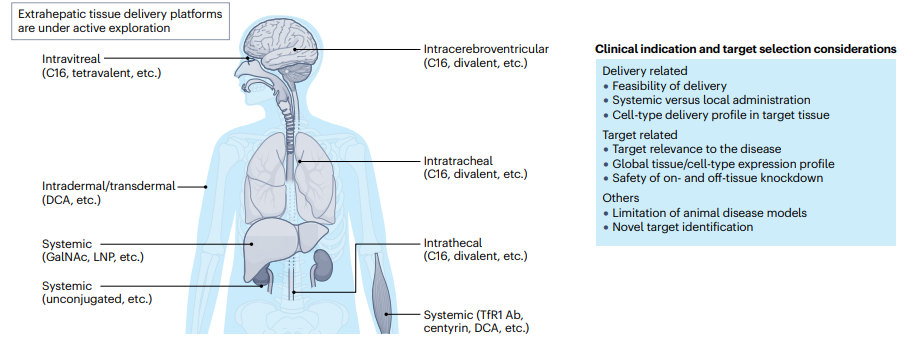
图2. 临床适应症和靶标选择
图片来源:参考资料1
在治疗肝病领域,siRNA药物已被视为一种首选的治疗策略,并已经获得临床验证。siRNA药物因其较低的用药频率和便利性,有望取代某些传统药物siRNA药物的持久性和安全性可能基因编辑方法获得临床接受的先决条件。例如,针对乙型肝炎的siRNA药物已进入了临床验证阶段。
此外,siRNA还可以作为长非编码RNA的治疗靶点,为治疗特定疾病提供新的选择。尽管目前对于针对长非编码RNA的药物研发仍处于初级阶段,但siRNA和其他寡核苷酸为基础的治疗方法在这一领域展现出了极高的潜力,未来有望在这一领域取得突破。
最后,siRNA与其他药物模式结合可能产生协同效应,为治疗复杂疾病带来新的可能性。例如,Alnylam的靶向C5补体siRNA药物cemdisiran与Regeneron的C5补体抑制剂pozelimab联合疗法在治疗阵发性夜间血红蛋白尿(PNH)显示出潜力。
未来,siRNA药物在临床应用中的潜力将继续被挖掘和拓展,我们有望看到更多具有广泛应用前景的RNAi药物问世。
更多有关siRNA药物的干货内容,可扫描下方二维码,观看《小核酸药物CMC研发要点与策略》直播回放:




